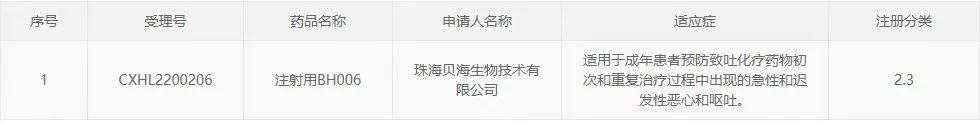
近日,珠海贝海生物技术有限公司(以下简称“贝海生物”)宣布,公司自主开发的新药项目BH006止吐新药正式获得国家药品监督管理局核准签发的《药物临床试验批准通知书》。这是贝海生物近期在中美获得的第7个临床试验批件。
截图来源:CDE官网
关于BH006
贝海生物自主开发的注射用BH006是全球首款福沙匹坦和帕洛诺司琼的固定复方制剂,为一款能同时阻断5-HT3受体和NK-1受体预防化疗所致的恶心呕吐的双通道复方制剂,拟用于成年患者预防:高度致吐化疗药物(HEC)初次和重复治疗过程中出现的急性和迟发性恶心和呕吐;中度致吐化疗药物(MEC)初次和重复治疗过程中出现的迟发性恶心和呕吐。
目前国内外均未有含福沙匹坦与帕洛诺司琼的复方制剂上市。福沙匹坦和帕洛诺司琼作为临床上广泛使用的止吐药,均已纳入各国肿瘤治疗恶心呕吐防治指南。
福沙匹坦在2008年先后获得欧洲EMA和美国FDA批准上市,2019年获中国NMPA批准上市,批准其联合5-HT3受体拮抗剂及地塞米松用于预防化疗所致的急性和迟发性恶心和呕吐。2018 年原研福沙匹坦(商品名:Emend®,含阿瑞匹坦口服制剂和福沙匹坦注射剂)全球销售额为5.22亿美元。作为临床急需药,2019年6月,福沙匹坦被正式列入国家《第一批鼓励仿制药品目录》中。
帕诺洛司琼是美国FDA批准的第四个用于治疗急性CINV的5-HT3受体拮抗剂,是第一个批准可用于中度致呕吐药物引起的延迟性恶心与呕吐的药物,该药于2003年获得美国FDA批准上市。
目前,在超过80亿规模的国内止吐药市场中,抗肿瘤化疗引起的恶心、呕吐用量较大的是5-HT3受体拮抗剂,及新一代止吐药NK-1受体拮抗剂类药物。目前国内外相继颁发多版CINV防治指南,根据不同致吐风险的药物以及呕吐的剧烈程度等因素选择单药或联合药用治疗。三联给药方案(5-HT3受体拮抗剂+NK-1受体拮抗剂+地塞米松)被广泛应用为CINV预防方案,与单药使用5-HT3受体拮抗剂相比,三药联用可显著提高临床疗效。
相较于传统的三药联用止吐方案,作为2.3类新药BH006兼具NK-1受体拮抗剂和5-HT3 受体拮抗剂的作用机制,每个疗程仅需注射给药1次,可减少给药次数,简化用药程序,从而提高指南依从性和患者依从性。BH006的开发,有望解决当前CINV管理存在的不足,如迟发性恶心呕吐控制不佳,指南依从性不佳,NK-1受体拮抗剂使用不足等问题。将为防治CINV提供一个更优的治疗方案,使患者不再畏惧化疗引起的恶心呕吐,改善CINV管理的同时为后续支持肿瘤治疗提供有力保障。
关于CINV
化疗和放疗是目前治疗恶性肿瘤的广泛应用手段,然而化疗患者都会出现不同程度的恶心和呕吐现象,即化疗所致的恶心呕吐(Chemotherapy Induced Nausea and Vomiting,CINV),是化疗患者最常见的不良反应,呕吐按发生时间分为先期性呕吐、急性呕吐和延迟性呕吐。根据《美国NCCN指南(2020年版)》以及《肿瘤药物治疗相关恶心呕吐防治中国专家共识(2019年版)》显示,临床上造成高度及中度致吐肿瘤药物多达近60种,许多癌症患者在按方案接受化疗的过程中,往往出现频繁和长时间的呕吐,严重影响了病人的进食及饮水,并因伴有不同程度的脱水、代谢紊乱,使体重下降,导致患者更加疲惫和虚弱。因而不少患者因惧怕恶心和呕吐反复发作,宁愿推迟甚至拒绝进一步治疗导致疗程受到影响。因此呕吐已成为癌症治疗过程中需要着重考虑的问题之一。这一不良反应不仅会影响患者的生活质量、降低患者的依从性,严重呕吐者还可致水电解质失衡、营养缺乏,从而使肿瘤控制不理想。因此,通过使用药物来预防或减少呕吐的发生,成为肿瘤患者支持治疗的重要内容。
关于贝海生物
贝海生物是一家处于临床阶段的生物医药企业,致力于开发以患者为中心临床需求未满足的肿瘤创新药。公司拥有全球首创的新药平台技术,具备持续的创新能力,前瞻性的布局了10余个差异化的创新药物研发管线,通过自主研发累计申请70余项发明专利申请,已获得近20项中国、美国、欧盟等发明专利授权。
目前,贝海生物1项新药产品已成功完成关键性临床试验,已进入NDA阶段,在中国、美国已获得7个临床试验许可(IND),多个项目已进入临床研究阶段。
贝海生物坚持以源头创新为核心驱动力,洞察并挖掘未被满足的临床需求,秉承“具有全球视野,聚焦临床价值”的开发策略,不断开发临床急需、安全、有效的肿瘤药物,为全球肿瘤患者提供更好的治疗方案,致力于成为在肿瘤领域一流的生物医药企业。
