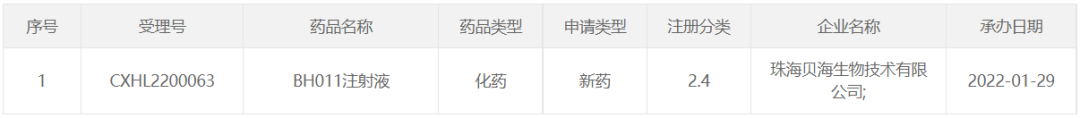
近日,贝海生物宣布,国家药品监督管理局药品审评中心已正式受理其自主研发的BH011注射液通过膀胱灌注治疗用于未经治疗或化疗后复发的中、高危非肌层浸润性膀胱癌的临床II期新适应症的临床试验申请。这是BH011项目继2021年获批进入I期临床后又一新适应症上取得研发进展。
关于BH011项目
BH011注射液是由贝海生物自主研发的全球首款可通过膀胱灌注给药的多西他赛创新药物,目前国内外无同类产品上市。BH011注射液拟用于非肌层浸润性膀胱癌(Non-muscle-invasive Bladder Cancer,NMIBC)的膀胱灌注治疗。BH011注射液能够显著增强多西他赛在膀胱组织中的渗透能力,使膀胱癌细胞暴露在更高浓度的药物下,提高了多西他赛对膀胱癌细胞的抗肿瘤活性。目前临床上可用于膀胱灌注的治疗药物包括化疗药物(如丝裂霉素C、表柔比星、吡柔比星、吉西他滨和羟基喜树碱等)和卡介苗为代表的免疫药物,但在疗效、安全性、可及性上存在重大未满足的临床需求。BH011临床前研究结果表明,多西他赛可进入膀胱固有层,提高了多西他赛对非肌层浸润性膀胱癌的抗肿瘤活性,且对膀胱无任何刺激性,系统毒性较小。BH011注射液有望成为NMIBC患者的临床一线用药。
关于NMIBC
膀胱癌是起源于膀胱尿路上皮的恶性肿瘤,是泌尿系统最常见的恶性肿瘤之一。如肿瘤未浸润膀胱肌层则为NMIBC(膀胱癌0、1期)。2016-2020年的中国NMIBC市场复合年增长率为11.0%,预计于2025年达到36亿元,2030年将达到88亿元。非肌层浸润性膀胱癌复发率高,是目前诊疗花费最高的肿瘤之一。在我国,NMIBC目前以TURBT(手术切除)为标准治疗手段,以膀胱化学灌注治疗以防止复发和进展。NMIBC 患者具有强烈的未被满足的临床需求:膀胱灌注药物失效后,没有良好的二线治疗方案选择,只能接受根治性膀胱全切切除术;现有临床使用药物在疗效、安全性、可及性上存在重大未满足的临床需求。
因此,临床急需一款新的疗效显著且不良反应少的膀胱灌注治疗药物用于治疗NMIBC。BH011有望降低该类患者的复发风险,提高患者生活质量。
关于贝海生物
贝海生物是一家处于临床阶段的生物医药企业,致力于开发以患者为中心临床需求未满足的肿瘤创新药。公司拥有全球首创的新药平台技术,具备持续的创新能力,前瞻性的布局了10余个差异化的创新药物研发管线,通过自主研发累计申请70余项发明专利申请,已获得16项中国、美国、欧盟等发明专利授权。
目前,贝海生物在中国、美国已获得5个临床试验许可(IND),多个项目已进入临床研究阶段。
贝海生物坚持以源头创新为核心驱动力,洞察并挖掘未被满足的临床需求,秉承“具有全球视野,聚焦临床价值”的开发策略,不断开发临床急需、安全、有效的肿瘤药物,为全球肿瘤患者提供更好的治疗方案,成为在肿瘤领域世界一流生物医药企业。
