近日,珠海贝海生物技术有限公司(以下简称“贝海生物”)宣布,国家药品监督管理局药品审评中心(CDE)已正式受理其具有自主知识产权的创新药物BH009用于治疗以头颈部鳞癌和卵巢癌为主的实体瘤的I期临床试验申请。
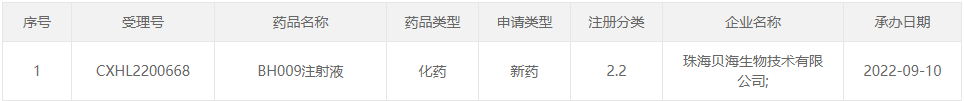
截图来源:CDE官网
关于BH009
BH009是贝海生物自主开发的不含吐温80的多西他赛创新产品,目前全球尚无同类产品上市。多西他赛是一线使用的肿瘤治疗基石药物之一,广泛用于实体瘤的治疗。目前多西他赛原研在国内获批的适应症包括乳腺癌,非小细胞肺癌,胃癌和前列腺癌,但头颈部鳞癌和卵巢癌这两个适应症尚未在国内获批。本次BH009临床试验申请是基于多西他赛在晚期头颈部鳞癌和铂耐药型卵巢癌的早期临床试验中得到充分验证的疗效证据和在头颈部肿瘤和卵巢癌肿瘤中的巨大未被满足的临床需求,拟在以头颈部鳞癌和卵巢癌为主的实体瘤患者中探索BH009的安全性、耐受性、药代动力学以及初步有效性。
与多西他赛原研相比,BH009因不含吐温80,有望消除与吐温80相关的严重毒副作用如超敏反应、体液潴留、肾毒性和神经毒性等,临床安全性更优。期待BH009在后续临床开发中取得更好的疗效和安全性数据,为我国晚期头颈部鳞癌和铂耐药卵巢癌的患者带来新希望,进一步拓展潜在获益人群。
关于头颈部鳞癌和卵巢癌
头颈部鳞癌
头颈部肿瘤是最常见的恶性肿瘤之一,包括颈部、耳鼻部以及口腔颌面部肿瘤,全球发病率逐年升高。其中,90%以上头颈部肿瘤的病理学类型是鳞状细胞癌(SCCHN),这类肿瘤的早期症状不明显,超过60%以上的SCCHN患者确诊时已处于局部晚期或转移性阶段。由于头颈部肿瘤解剖位置的特殊性、且类型复杂多样,对患者外貌和基本生理功能、感觉功能和语言功能都产生较大破坏,严重影响患者的生活质量。
根据世界卫生组织(WHO)发布的统计数据显示,2020年全球头颈部鳞癌(不含鼻咽癌)新发病例超150万,死亡人数超37万;中国头颈部鳞癌(不含鼻咽癌)新发病例近8万人,死亡人数超过4万。现有的SCCHN的标准治疗手段是手术+放化疗,但用于治疗晚期癌症患者的效果有待提高,SCCHN的5年总生存率(overall survival, OS)小于50%。
2015年,SCCHN药物全球市场总份额达4.8亿美元,由于头颈部鳞癌患者巨大未被满足的临床需求,SCCHN药物全球市场有望在2025年份额达到约28亿美元,年均增长率高达19%。
卵巢癌
卵巢恶性肿瘤包括多种病理类型,其中最常见的是上皮性癌,约占卵巢恶性肿瘤的80%,其次是恶性生殖细胞肿瘤和性索间质肿瘤,各约占10%和5%。70%以上的卵巢癌发现时已是晚期,且70%以上的卵巢癌即使规范治疗也会复发,5年生存率仅为30%。
长期以来,卵巢癌的治疗效果一直未能得到有效改善。尽管临床上采用手术联合含铂化疗一线治疗缓解率可达80%,但70%的患者即使是经过了标准手术、化疗之后,仍会在三年内复发,大多数患者最终会对化疗药物产生耐药性。“铂耐药”就是目前卵巢癌治疗面临的巨大挑战。目前临床上用于铂耐药型复发卵巢癌非铂类单药化疗虽然种类繁多,例如拓扑替康、吉西他滨、脂质体多柔比星、口服依托泊苷和紫杉醇等,但总体缓解率相似,在有效性上均具有一定的局限性。
根据世界卫生组织(WHO)2020年发布的统计数据显示,全球女性癌症发病人数中,卵巢癌排第8位,新发病例高达31万,死亡人数超21万,其中中国6万例,死亡病例4万。
全球卵巢癌市场在2018年为18亿美元,该市场预计在2028年将达到67亿美元,预测期内(2018-2028)的年复合增长率为14.4%。
关于贝海生物
贝海生物是一家处于临床阶段的生物医药企业,致力于开发以患者为中心临床需求未满足的肿瘤创新药。公司拥有多个全球首创的新药技术平台,具备持续的创新能力,已前瞻性的布局了10余个差异化的创新药物研发管线,并获得20余项中国、美国、欧盟已授权发明专利。
目前,贝海生物有数个新药项目已经进入NDA申报和关键性临床试验阶段,已在中国、美国获得7个临床试验许可(IND)。
贝海生物坚持以源头创新为核心驱动力,洞察并挖掘未被满足的临床需求,秉承“具有全球视野,聚焦临床价值”的开发策略,不断开发临床急需、安全、有效的肿瘤药物,为全球肿瘤患者提供更好的治疗方案,致力于成为在肿瘤领域一流的生物医药企业。
