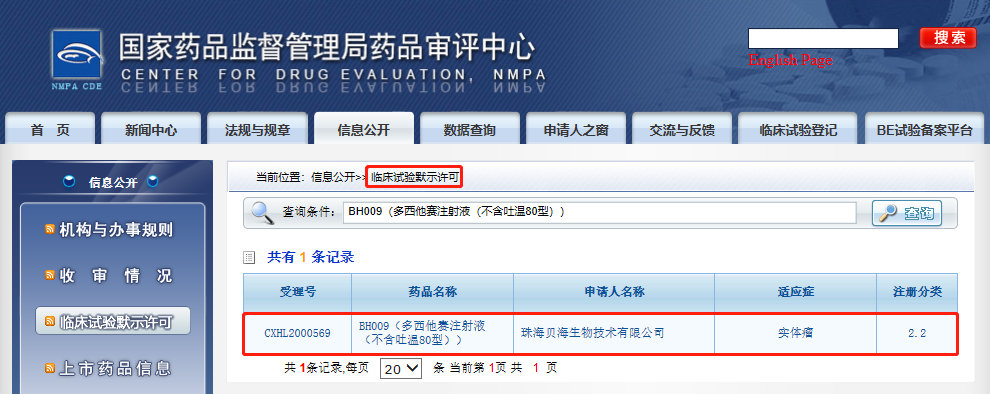
近日,珠海贝海生物取得重大进展,公司自主研发的BH009多西他赛注射液(不含吐温80型)新药临床试验申请(IND)获得国家药品监督管理局核准签发的《药物临床试验批准通知书》,批准开展BH009在实体瘤中的临床试验,该临床试验将为实体瘤的患者治疗提供全新的更优的治疗方案。
这是BH009继2020年8月在美国FDA率先获得临床试验批件后在中国CDE又获得该项目临床试验批件。
多西他赛是广谱抗肿瘤药物,一直是乳腺癌、非小细胞肺癌、卵巢癌等癌症的一线治疗用药,且为国家医保品种,临床需求较大。中国公立医疗机构终端多西他赛年销售额近50亿元。
BH009(多西他赛注射液(不含吐温80型))是贝海生物自主研发的2.2类改良型新药,不含吐温80的多西他赛创新产品,目前全球尚无同类产品上市。现有的原研及仿制药均含有吐温80(一个工业乳化剂作为溶剂),在临床使用过程中吐温80会产生严重过敏反应、体液潴留等严重毒副作用。贝海生物的多西他赛新药产品完全不含吐温80,能明显改善现有多西他赛产品严重毒副作用,将为癌症患者提供一个更安全、有效的药物。贝海多西他赛创新产品BH009在技术领先性、开发速度、安全性方面相比同类产品都具有明显优势。
贝海生物创始人、董事长孙群博士表示:
BH009多项临床前试验取得了令人振奋的研究结果,对于一家年轻的生物技术公司来说,BH009相继在中美两国顺利获得临床批件,是公司发展历程中的一个重大里程碑,标志着贝海进入全新的发展阶段,BH009已在海外开展人体临床试验,我们将积极推进临床试验研究,加速BH009临床试验的进程,贝海生物将坚守初心,继续带来创新的、革命性的解决方案,满足亟待解决的临床需求,为临床提供更加安全有效的临床治疗方案,惠及更多患者。
关于贝海
贝海生物是一家处于临床阶段的生物医药企业,致力于创新药和改良型新药的发现和开发,为全球患者提供更安全、更有效的创新抗肿瘤药物。公司通过自主研发拥有12项授权发明专利70余项发明专利申请,已成功开发了一个提高难溶性注射剂药物溶解度的开创性平台型技术,拥有10余个用于治疗肿瘤、疼痛等重大疾病的创新药物管线。BH009改良型多西他赛项目已在美国FDA和中国CDE获准实施临床试验,已在海外开展临床试验,贝海生物的BH009项目在开发速度、安全性方面相比同类产品中都具有明显优势。其他多个新药项目也已进入IND阶段。贝海生物期望通过突破性的研发创新和差异化的发展战略,紧密关注临床需求,以“具有全球视野,聚焦药品价值”的开发策略,解决亟待满足的临床需求,致力于成为国际领先的生物制药企业。
